Source: Inserm
Comment le virus VIH parvient-il à échapper à la vigilance du système immunitaire, à l’intérieur même des cellules qu’il infecte ? C’est sur un de ces mécanismes d’évitement que se sont penchés des chercheurs de l’Inserm, du CNRS, de l’Université de Montpellier et de l’Université de Lorraine. Ils ont pu observer la capacité du VIH à « camoufler » son ARN au sein même de la cellule infectée en utilisant une enzyme intracellulaire. Ces travaux parus dans Nature apportent de nouvelles connaissances sur les mécanismes d’évasion du VIH face au système immunitaire inné.
Dès les premières étapes d’une infection virale, les « radars » intracellulaires de l’immunité innée permettent de déclencher rapidement une réponse antivirale via la sécrétion d’interférons de type I, protéines fabriquées par les globules blancs pour réguler et stimuler la réponse immunitaire.
Le virus de l’immunodéficience humaine (VIH) cible les cellules du système immunitaire et provoque des immunodéficiences sévères responsables du SIDA. Lorsque le VIH infecte une cellule, son génome composé d’ARN simple brin est transformé en ADN. Il va ensuite s’importer dans le noyau de la cellule hôte où il s’intègre à son génome. Le succès de ces étapes précoces dépend de la capacité du virus à se camoufler dans la cellule et à passer inaperçu en échappant aux détecteurs cellulaires, notamment à ceux capables de reconnaître les acides nucléiques de son génome comme un ARN étranger à l’organisme.
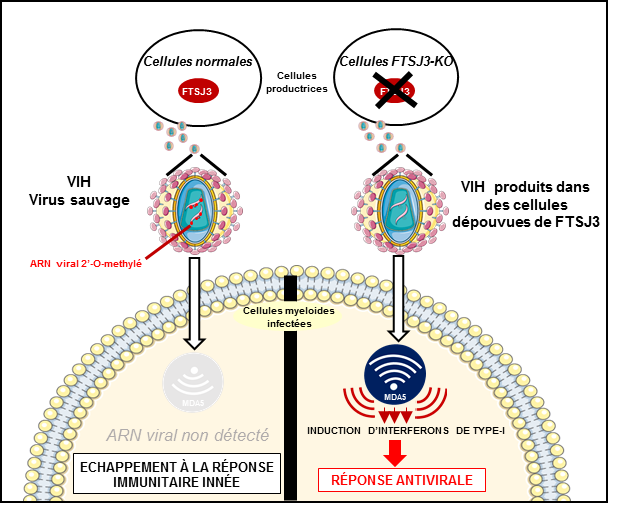
Des chercheurs de l’Inserm, du CNRS, de l’Université de Montpellier et de l’Université de Lorraine se sont intéressés à ce mécanisme permettant au VIH d’échapper à la vigilance des cellules en exploitant un système de camouflage. Au sein des cellules, on trouve une enzyme appelée FTSJ3 qui est capable de modifier certains des acides nucléiques composant un ARN cellulaire en leur ajoutant un groupement méthyle. Cette modification est une signature du soi (ensemble des molécules résultant de l’expression du génome de l’individu, à opposer au non soi) qui permet aux détecteurs de reconnaître les ARN cellulaires comme tels dans les cellules humaines et d’éviter leur destruction par le système immunitaire.
L’équipe de recherche a pu mettre en évidence que le VIH recrute l’enzyme FTSJ3 pour méthyler son propre ARN génomique. Les détecteurs cellulaires d’ARN étranger s’avèrent alors incapables de reconnaître comme étranger cet ARN viral ainsi « camouflé » et ne peuvent donc déclencher la production d’interférons de type I au sein de la cellule pour induire la réponse immunitaire. Le virus invisible est alors libre de transformer son ARN en ADN, d’intégrer le génome de la cellule et de poursuivre l’infection.
Ces résultats constituent une avancée significative dans la compréhension de l’infection par le virus VIH en révélant une nouvelle stratégie d’évasion du virus face au système de détection cellulaire du système immunitaire inné. Mieux comprendre ces mécanismes de contournement pourrait permettre à plus long terme de développer des approches thérapeutiques et/ou vaccinales visant à modifier le virus afin qu’il entraîne l’établissement d’une réponse antivirale qui, lorsqu’elle est précoce, permet à la cellule de mettre en place une réponse immunitaire et de maîtriser l’infection.