Source : Techno Sciences
En étudiant la structure de récepteurs cellulaires et des molécules qui les activent, des scientifiques des universités de Genève et de Bâle décryptent le mécanisme précis d’activation des cellules immunitaires.
Situés sur la membrane de nombreuses cellules immunitaires, les récepteurs aux chémokines jouent un rôle important dans leur activation défensive. Les chémokines sont de petites protéines qui se lient à ces récepteurs et contrôlent le mouvement et le comportement des globules blancs. Malgré l’importance de cette famille de récepteurs, leur mécanisme d’activation reste encore méconnu. Un consortium de recherche de l’Université de Genève (UNIGE), du Biozentrum de l’Université de Bâle et de l’Institut Paul Scherrer (PSI) de Villigen est parvenu à décrypter le mécanisme d’activation du récepteur CCR5, un membre de cette famille impliqué dans plusieurs maladies, notamment le VIH/SIDA, le cancer ou encore les complications respiratoires du COVID-19. Cette découverte représente une étape importante dans la compréhension de la biologie des récepteurs aux chémokines, fournissant de précieuses indications pour améliorer l’efficacité et le ciblage de nombreux médicaments dont le mode d’action vise ce mécanisme. Ces travaux sont à découvrir dans la revue Science Advances.
Le récepteur CCR5 joue un rôle majeur dans l’inflammation et la défense immunitaire, et est depuis longtemps une cible importante des médicaments anti-VIH. « Les recherches sur CCR5 ont débuté il y a près de 25 ans, dans le cadre de la lutte contre le SIDA », explique Stephan Grzesiek, professeur au Biozentrum de l’Université de Bâle, qui a co-dirigé ces travaux avec le professeur Oliver Hartley du Département de pathologie et immunologie de la Faculté de médecine de l’UNIGE et une équipe de l’Institut Paul Scherrer (PSI). « Il est en effet à la base du mécanisme d’invasion du VIH dans l’organisme, mais semble également très important dans de nombreux autres processus pathologiques, notamment dans les cancers et les maladies inflammatoires. Mais pour pouvoir mieux l’exploiter dans un but thérapeutique, nous devions comprendre, à un niveau atomique, comment il est activé en entrant en liaison avec des chémokines. »
Les chémokines sont de petites molécules de signalisation dont le rôle est essentiel pour la migration et l’activation des cellules immunitaires. En se fixant aux récepteurs situés sur la membrane des globules blancs, elles agissent comme guide et permettent à ceux-ci de se trouver au bon endroit et au bon moment pour assurer l’organisation du système immunitaire et son activation en cas d’infection ou de blessure. Mais comment, concrètement, le récepteur ressent-il l’arrimage d’une chémokine depuis l’extérieur de la cellule ? Puis comment ce message d’activation est-il transmis à l’intérieur de la cellule pour qu’elle organise sa réponse ?
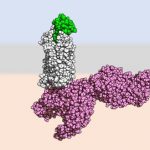
Visualiser les structures atomiques en 3D
Jusqu’ici, l’étude de ce phénomène était freinée par la difficulté d’observer les structures en 3D des récepteurs lorsqu’ils sont liés aux molécules activatrices. Pour ce faire, l’équipe bâloise, spécialiste de biologie structurale, a eu recours à des outils de cryo-microscopie électroniques qui permettent de préserver et d’observer la structure des plus petits éléments du vivant. « Cependant, afin de comprendre l’entièreté du processus, il fallait utiliser des chémokines modifiés pour se fixer aux récepteurs de manière plus stable que les chémokines naturelles », indique Oliver Hartley. « Et nous avions justement développé par bio-ingénierie une série de telles molécules au cours de nos recherches sur les médicaments anti-VIH. » Les scientifiques ont ainsi pu observer que certains de ces variants sur-activent le récepteur alors que d’autres les bloquent complètement.
La bonne clé pour la bonne serrure
Le récepteur, intégré à la membrane cellulaire, fonctionne par un mécanisme de clé et de serrure. Une partie spécifique de la structure des chémokines doit s’insérer dans la serrure du CCR5 pour activer un changement de la structure du récepteur qui déclenche alors l’activation et la migration des globules blancs. « La capacité d’activation des chémokines est déterminée par certains acides aminés (les briques de construction des protéines) qui doivent s’arranger selon un schéma précis. Si la chémokine adopte une forme droite, elle parvient à activer le récepteur. Mais en cas de modification de ces acides aminés, la molécule adopte une forme légèrement différente qui, même si elle permet de conserver une liaison très forte avec le récepteur, empêche son activation », explique Oliver Hartley. Ce sont ces petites modifications de précision qui font la différence entre les activateurs et les inhibiteurs du récepteur.
Des médicaments mieux ciblés, donc plus efficaces
Ainsi, malgré une architecture quasiment identique, d’infimes différences structurelles des chémokines déterminent leur capacité à activer ou à inhiber le récepteur. La compréhension détaillée de ce mécanisme permettra d’améliorer les médicaments en développant de nouveaux composés capables d’influencer le système immunitaire de manière très spécifique.